本文转载自安捷伦细胞分析微信公众号。
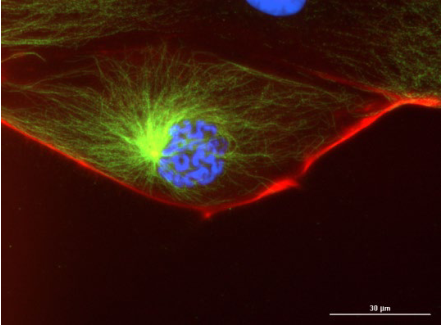
细胞分析可以提供直观而丰富的试验结果,但是其过程也面临着诸多的挑战,回忆一下,当你小心翼翼地对你精心呵护的细胞完成一系列操作之后,满怀期待的打开显微成像系统,对即将呈现在你眼前的美丽又可爱的细胞倩影满怀期待的时候,你是否
因为总是找不到细胞或者焦平面而急躁?
因为刚刚找到的视野又不见了而悔恨?
因为前几个小时还神采奕奕的细胞突然就垮了
十个提升细胞成像分析成功率的小技巧送给你!
6. 选择合适的聚焦方式
明场自动对焦
图像自动对焦是自动化成像中最常采用的方法。无标记细胞分析的图像对焦需要使用明场或相差光路,因为无标记的细胞与背景之间的对比度有限,所以对样品进行适当照明很重要。
开始操作时,可以采用手动成像的方式,找到样本聚焦的 Z 轴高度,并将此值在软件中该器皿的条件内设定,以便在使用该器皿时,仪器会使用适当的垂直高度开始自动对焦过程,可以最大限度地减少对焦时间。
荧光成像对焦
使用荧光成像方法,可以通过荧光信号实现自动对焦。此种方法在许多情况下都可以提高对焦的简便性,但在个别情况下需要注意调整:对于较强的荧光信号,自动聚焦更容易找到合适的焦平面,减少每个样品的对焦时间;但相反,若是荧光基团的信号较弱或背景信号较高则会降低图像内的对比度,并很有可能引起失焦。
在使用具有高数值孔径和有限景深的物镜时,还需要考虑到荧光基团在细胞中的定位。对核染色可以准备把焦平面定位在核上,但当使用第二个通道对位于质膜的荧光基团所发出的荧光进行成像时,由于这两个荧光基团处于稍有不同的焦平面上,图像有可能无法正确对焦。使用固定的Z轴偏移可以适应这种差异,并且可以容易地校正这种差异。
固定对焦方式
最后,当样品在多个孔或视野的焦平面高度一致性时,或者仅需要对实验过程或细胞状态进行粗略观察时,可以使用固定对焦代替自动对焦,在尽可能短的处理时间内对所有样品进行成像。
7. 图像采集(曝光)的设置
图像采集设置
合适的图像采集设置对于获得有意义、可量化的数据和可用于出版的图像是至关重要的。这些设置通常包括激发光强度、相机增益和积分时间。定性显微镜使用图像采集设置,以提供最佳的图像;定量数字显微镜调整曝光参数以便尽可能地利用相机的整个 bit 深度。
避免过度饱和
在一次实验中对整个孔板进行固定曝光成像时,尽可能使用阳性和阴性对照来进行曝光设置,有助于避免像素饱和,同时,持续曝光可以准确量化测试样品之间的荧光变化。由于过曝无法定量,动态范围的上限会被截断,相反地,如果参数设置得太低(通常为了隐藏“背景”荧光),数据又会在动态范围的下限被截断,并再次扭曲定量检测结果。
手动成像
手动成像也可以用于图像采集设置,将得到的最终参数转移到自动成像的步骤。如果测试孔之间,或样品对照孔之间的荧光发生变化,则自动曝光功能就不可使用,因为成像仪会试图通过相应的参数调整来补偿高/低信号。这将导致数据均化,并消除预期的检测窗口。如果只有单个样品需要分析,或者实际信号值之间的比较不是分析标准的一部分,那么自动曝光还是很实用的。
8. 动态成像
实时追踪细胞变化的动态成像,相比终点法,能够捕捉到可能会被遗漏的重要细微差别。动态成像的另一个好处是通过时间延迟成像获得动态的视频,除了可以进行数值量化以为,还可以可视化预期的变化。然而,和所有成像实验一样,动态成像也必须遵循一定的指导方针,才能获得尽可能好的图像和数据。
在动力学实验中建议采用固定曝光。因为实验设计中尽可能希望量化样品在孵育期发生的变化,而采用固定曝光可以防止动态成像阶段的数据均化。如果预期信号值会减少,应使用阳性对照进行参数优化;如果预计信号值会增加,则应使用阴性对照。还要注意的是,避免过低的参数设置,以免使预期出现的信号变化超出线性范围。选用稳定的荧光基团,保证其在整个成像过程中对光漂白的敏感性较低。
9. 像素的位移
像素偏移是指由于成像路径中的滤镜使光线发生偏移,导致在高分辨率 CCD 相机上检测到的图像发生移位。通常这是由于发射滤光片的厚度不均造成的,这也被称为滤光片楔形。在使用不同的荧光通道获得同一样品的两个或多个图像,然后叠加以同时观察来自多个荧光基团的荧光时,这种偏移就会出现问题。因为每个图像都会因每一个滤光片组中不同的楔形角度而发生位移,所以由不同荧光基团产生的图像将无法被准确地关联或组合起来。
校准程序(Calibration procedure)
纵使是再昂贵的物镜和滤光片也依然会存在一定的偏差,可以用校准程序来进行修正。对于自动化的数字显微镜,这一步通常是在 LED 和物镜校准时完成的。使用明场作为照明参考,通过测定光圈中心即可测得每组 LED 和物镜的像素偏移。然后计算出每个像素的像素偏移用来调整图像,使多个通道图像可叠加在适当的位置。
通道转换工具(The channel shift tool)
一些数字显微镜软件可以在成像后使用通道转换工具来对多色图像中的单个颜色进行重新定位。举例来讲,在单独的荧光彩色成像步骤中移动的活细胞样品,可能会导致重叠图像与不同颜色发生轻微错位。这是由于不同颜色的通道是按顺序成像的,而在成像与可捕捉样品运动之间存在一个很短的时间间隔,通道转换工具使得研究人员可以重新定位通道来进行校正。
10. 创造有利的环境条件
温度控制
活细胞的长期动态成像通常需要对环境条件进行一定程度的控制,以维持样品的活性。温度是一个主要考虑因素。虽然大多数哺乳动物细胞的生长条件是 37℃ ,但如果要使用细菌或酵母细胞,可能需要更高或者更低的温度。进行手动预设置或者在实验程序中添加温度控制的步骤,可以确保在成像时保持样本在适当的温度。
气体控制
气体控制也很关键。例如,使成像仓内保持 5% 的二氧化碳浓度,可为哺乳动物细胞提供合适的气体环境。在进行低氧诱导时,则需要设置合适的氧气浓度。
温度和气体控制装置可以为活细胞动态监测提供正确的温度和气体条件,避免在长时间的动态成像过程中牺牲样本的完整性。
如果你现在还没有找到合适的活细胞成像平台,那么你可以了解下安捷伦 BioTek 微孔板成像检测系统,该系统集多功能微孔板检测和多功能活细胞全自动显微成像于一体。在细胞增殖,细胞运动,细胞遗传毒性检测,细胞免疫反应,病毒疫苗研发,3D 细胞培养、类器官药敏检测以及模式生物如斑马鱼研究方面均有优秀的表现。该系统具有成像质量高、环境监控严格、自动化操作、高通量智能化分析等特点,可安全、灵活的完成各类基于活细胞的检测分析,无论是简单的细胞拍摄还是长达数周的细胞培养观测均能胜任。
仅限研究使用。不可用于诊断目的。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。